ウステキヌマブとは
開発の経緯
ウステキヌマブは、遺伝子組換え完全ヒト免疫グロブリンG1κ(IgG1κ)モノクローナル抗体で、ヒトサイトカインのインターロイキン(IL)-12及びIL-23に共通するp40タンパク質サブユニットに特異的に結合する。これによって、ヘルパーT細胞1及びヘルパーT細胞17の活性化を抑制し、これらの関連する疾患に対する臨床的作用を発揮する。
ウステキヌマブBS皮下注45mgシリンジ「F」(以下、「本剤」)は尋常性乾癬、関節症性乾癬、活動期クローン病、潰瘍性大腸炎を適応とする先行バイオ医薬品ステラーラ皮下注45mgシリンジ(一般名:ウステキヌマブ[遺伝子組換え])のバイオ後続品としてAlvotech社により開発された。本邦では富士製薬工業株式会社が、Alvotech社との独占的パートナーシップの合意に基づき、「バイオ後続品の品質・安全性・有効性確保のための指針」を踏まえた品質特性に関する試験及び非臨床試験を実施し、本剤と先行バイオ医薬品である欧州で承認されたウステキヌマブ製剤(EU)との同等性を検討した。
また、臨床試験では、健康成人を対象とした臨床薬理試験及び尋常性乾癬患者を対象とした検証試験において、本剤とEUとの同等性を検討した。富士製薬工業株式会社は、品質、非臨床、臨床のそれぞれの試験において、本剤と先行バイオ医薬品の同等性/同質性が示されたこと及び申請効能・効果のいずれに対してもウステキヌマブの作用機序は共通で同様の有効性が期待できることから、ステラーラで承認されている効能・効果、用法・用量が本剤に外挿可能と考え、本剤をウステキヌマブのバイオ後続品として、医薬品製造販売承認申請を行い、2023年9月に承認を取得した。
特性
製品の治療学的特性
1.先行バイオ医薬品との同等性・同質性が臨床薬理試験、非臨床試験、品質に関する試験によって確認されています。
2.中等症又は重症の尋常性乾癬患者を対象とした第Ⅲ相臨床試験により先行バイオ医薬品との臨床的同等性が確認されています。
3.重大な副作用として、アナフィラキシー(頻度不明)、重篤な感染症(1~ 5%未満)、結核(頻度不明)、間質性肺炎(頻度不明)が報告されています。
なお、主な副作用として、鼻咽頭炎、上気道感染、頭痛、浮動性めまい、咽喉頭疼痛、悪心、嘔吐、発疹、そう痒症、関節痛、注射部位反応、疲労が報告されています。
製品の製剤学的特性
1.IL-12及びIL-23のp40サブユニットに結合する遺伝子組換え完全ヒト免疫グロブリンG1κモノクローナル抗体であるウステキヌマブとして日本初のバイオ後続品です。
2.穿刺防止安全装置付きのプレフィルドシリンジ製剤です。
有効成分に関する理化学的知見
一般名:
ウステキヌマブ(遺伝子組換え)[ウステキヌマブ後続1]
Ustekinumab (Genetical Recombination)[ Ustekinumab Biosimilar 1]
分子式:
H鎖 C2207H3410N582O671S17
L鎖 C1034H1596N274O337S6
分子量:
H鎖 49,377.29
L鎖 23,449.76
本 質:
ウステキヌマブ[ウステキヌマブ後続1](以下、ウステキヌマブ後続1)は、インターロイキン(IL)-12及びIL-23のp40サブユニットに対する遺伝子組換えモノクローナル抗体であり、ヒトIgG1に由来する。ウステキヌマブ後続1は、Sp2/0細胞により産生される。ウステキヌマブ後続1は、449個のアミノ酸残基からなるH鎖(γ1鎖)2本及び214個のアミノ酸残基からなるL鎖(κ鎖)2本で構成される糖タンパク質(分子量:約149,000)である。
ウステキヌマブ(遺伝子組み換え)[ウステキヌマブ後続1]の主な糖鎖構造
![ウステキヌマブ(遺伝子組み換え)[ウステキヌマブ後続1]の主な糖鎖構造](../img/about/img-03.png)
薬物動態
血中濃度
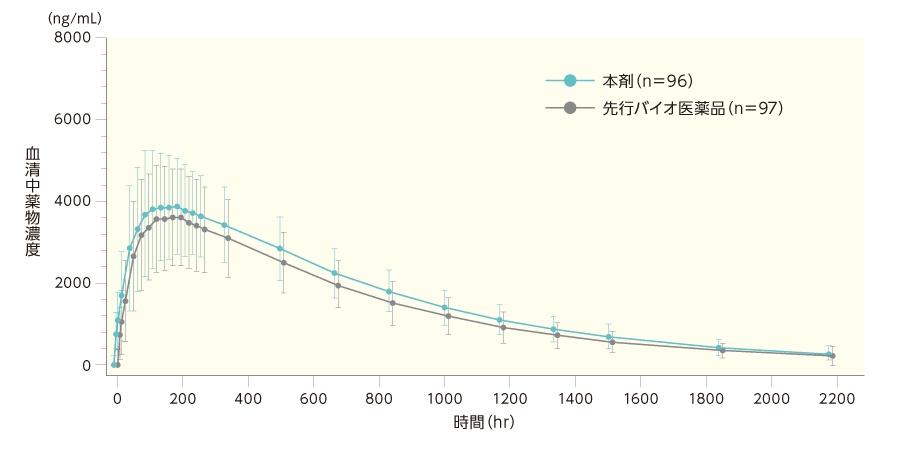
単回投与時の血清中濃度(健康成人:日本人を含む外国人データ)1)
海外において、日本人を含む健康成人に本剤及び先行バイオ医薬品注1)をウステキヌマブ(遺伝子組み換え)として45mgを単回皮下投与し、薬物動態(PK)を検討した。PK解析対象(本剤:96例、先行バイオ医薬品:97例)におけるPKパラメータ(Cmax、AUC0-t、AUC0-inf、Tmax及びt1/2)を下記に示す。このうちCmax及びAUC0-tの幾何最小二乗(LS)平均値比の90%信頼区間はいずれも生物学的同等性の基準範囲内(0.80 ~ 1.25)であった。
注1)先行バイオ医薬品:欧州で承認されたウステキヌマブ製剤
本剤及び先行バイオ医薬品の血清中薬物濃度推移
本剤及び先行バイオ医薬品のPKパラメータ
| Cmax | AUC0-t | AUC0-inf | Tmax | t1/2 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | ng/mL | n | h・ng/mL | n | h・ng/mL | n | hr | n | hr | |
| 本剤 | 96 | 4,225 (1,348.22) |
96 | 3,432,850 (969,366) |
93 | 3,679,852 (1,066,729) |
96 | 180.22 (88.639) |
96 | 492.33 (124.766) |
| 先行バイオ 医薬品 |
97 | 3,906 (1,247.47) |
97 | 3,044,207 (943,154) |
97 | 3,206,783 (1,029,191) |
97 | 175.12 (78.833) |
97 | 446.75 (109.936) |
n:被験者数、平均値(標準偏差)
薬効薬理
作用機序
In vitro 試験において、本剤はヒトインターロイキン(IL)-12及びIL-23を構成するp40たん白サブユニットに特異的かつ高い親和性で結合し2)、IL-12及びIL-23受容体複合体への結合を阻害した3)。
ウステキヌマブ「F」のヒトIL-12及びIL-23に対する作用機序[皮膚]
![ウステキヌマブ「F」のヒトIL-12及びIL-23に対する作用機序[皮膚]](../img/about/img-05.png)
非臨床試験
p40、IL-12及びIL-23結合活性(In vitro )4)
本剤、EU及びUSのp40、IL-12及びIL-23に対する結合活性を表面プラズモン共鳴法で結合親和性を測定することで評価した。本剤はp40、IL-12及びIL-23に対して結合し、本剤の結合活性は欧州で承認されたウステキヌマブ製剤及び米国で承認されたウステキヌマブ製剤と同程度であった。
IL-12介在性のIFN-γ放出に対する阻害活性(In vitro )5)
本剤、EU及びUSのIL-12中和活性をNK92細胞からのインターフェロンガンマ(IFN-γ)放出に対する阻害を測定する細胞ベースのIL-12中和アッセイを用いて評価した。本剤はIL-12介在性のINF-γ放出を阻害し、本剤の阻害活性は、欧州で承認されたウステキヌマブ製剤及び米国で承認されたウステキヌマブ製剤と同程度であった。
安全性薬理試験及び毒性試験
毒性試験6)
反復投与毒性試験(カニクイザル)
カニクイザルに本剤(0、5、15、45mg/kg)及び中国で承認された先行バイオ医薬品(45mg/kg)を週1回、4週間反復皮下投与した結果、明らかな毒性及び投与部位に刺激性は認められなかった。試験期間を通じて死亡は認められず、一般状態、心血管系、中枢神経系、呼吸器系、臓器・組織の肉眼的及び組織学的検査に投与に関連した変化は認められなかった。本剤の無毒性量は45mg/kgであった。
局所刺激性試験(カニクイザル)
反復投与毒性試験において、各投与前及び投与翌日に全例の投与部位を観察したが、明らかな毒性及び投与部位の刺激性は認められなかった。
1)Christopher Wynne et al., Expert Opin Investig Drugs. 2023;32(5):417-427
2)Luo J, et al.:J Mol Biol. 2010;402:797-812
3)ウステキヌマブのヒトIL-12及びIL23中和作用機序
(ステラーラ皮下注シリンジ:2011年1月21日承認、CTD2.6.2.1)
4)社内資料:薬理作用に関連する試験 −p40、IL-12及びIL-23に対する結合活性−
5)社内資料:薬理作用に関連する試験 −効力−
6)社内資料:反復投与毒性試験

