
投与前にご確認いただきたいこと
本剤の警告
- 本剤はIL−12/23の作用を選択的に抑制する薬剤であるため、感染のリスクを増大させる可能性があります。また、症状を悪化させる可能性があるため、活動性結核や重篤な感染症を有する患者様には投与しないでください。
- 本剤との因果関係は不明ですが、悪性腫瘍の発現が報告されています。悪性腫瘍の既往歴のある患者様及び合併している患者様への投与は十分に注意してください。
1. 警告
1.1本剤はIL−12/23の作用を選択的に抑制する薬剤であるため、感染のリスクを増大させる可能性がある。また、結核の既往歴を有する患者では結核を活動化させる可能性がある。また、本剤との関連性は明らかではないが、悪性腫瘍の発現が報告されている。本剤が疾病を完治させる薬剤でないことも含め、これらの情報を患者に十分説明し、患者が理解したことを確認した上で、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、本剤投与後に副作用が発現した場合には、主治医に連絡するよう患者に注意を与えること。[2.1、8.1-8.3、9.1.1-9.1.3、11.1.2、11.1.3、15.1.6 参照]
1.2重篤な感染症
ウイルス、細菌及び真菌による重篤な感染症が報告されているため、十分な観察を行うなど感染症の発症に注意すること。[2.1、8.1、9.1.1、11.1.2 参照]
1.3結核等の感染症について診療経験を有する内科等の医師と十分な連携をとり使用すること。[2.2、8.2、9.1.2、11.1.3 参照]
1.4本剤の治療を開始する前に、適応疾患の既存治療の適応を十分勘案すること。[5.1 参照]
1.5本剤についての十分な知識と適応疾患の治療の知識・経験をもつ医師が使用すること。
電子化された添付文書からの抜粋
適応となる患者様
本剤の効能又は効果(電子化された添付文書からの抜粋)
4. 効能又は効果
○既存治療で効果不十分な下記疾患
尋常性乾癬、関節症性乾癬
5. 効能又は効果に関連する注意
5.1 以下のいずれかを満たす尋常性乾癬又は関節症性乾癬患者に投与すること。[1.4 参照]
- 紫外線療法を含む既存の全身療法(生物製剤を除く)で十分な効果が得られず、皮疹が体表面積の10%以上に及ぶ患者。
- 難治性の皮疹又は関節症状を有する患者。
乾癬における生物学的製剤の使用ガイダンス(2022年版)
「生物学的製剤の対象患者<対象患者についての重要な注意事項>」
尋常性乾癬に対する生物学的製剤の使用にあたっては、原則としてまず他の全身療法を考慮すべきである。したがって、尋常性乾癬におけるその適応患者とは、シクロスポリンやエトレチナート、メトトレキサート、アプレミラストなどの内服療法、PUVAやナローバンドUVBなどの紫外線療法において、
- 満足のいく治療効果が得られない患者、
- 副作用が実際に発現しており、十分な用量の内服または照射ができない患者、
- 治療は有用であるが、減量や中止により容易に再燃を繰り返すため減量中止が困難で、長期にわたる蓄積性副作用が強く懸念される患者、
- 治療禁忌となるような合併症などの存在により、治療が困難な患者、
などが該当する。いっぽう、進行性の関節破壊をきたす関節症性乾癬については、日常生活に支障が現れる以前に関節破壊を抑制することが重要であり、状況に応じて、関節破壊の進展抑制のエビデンスを有する強力な治療の導入を、早期から考慮することが推奨される。
日本皮膚科学会乾癬分子標的薬安全性検討委員会.:日皮会誌.;132(10):2271-96. 2022.
適応とならない患者様
本剤の禁忌
2. 禁忌(次の患者には投与しないこと)
2.1 重篤な感染症の患者[症状を悪化させるおそれがある。][1.1、1.2、8.1、11.1.2 参照] |
本剤は、IL−12/23の作用を選択的に抑制する薬剤であり、感染症のリスクを増大させる可能性があります。重篤な感染症の患者様においては、本剤を投与しないでください。 |
|---|---|
2.2活動性結核の患者[症状を悪化させるおそれがある。][1.3、8.2、11.1.3 参照] |
本剤は、IL-12/23の作用を選択的に抑制する薬剤であり、結核を増悪させる可能性があります。活動性結核の患者様においては、本剤を投与しないでください。 検査フロー |
2.3本剤の成分に対し過敏症の既往歴のある患者 |
本剤の成分に対し、過敏症の既往歴のある患者様においては、本剤の投与により過敏症を引き起こす可能性があるため、投与しないでください。 |
表中の項目番号は電子化された添付文書に則って記載
特定の背景を有する患者様に関する注意
|
9.1 合併症・既往歴等のある患者 |
9.1.1 感染症(重篤な感染症を除く)の患者、感染症が疑われる又は再発性感染症の既往歴のある患者 |
本剤の免疫抑制作用により、既存の感染症を悪化、顕在化させるおそれがあります。感染症(重篤な感染症を除く)の患者様、感染症が疑われる患者様又は再発性の感染症の既往歴のある患者様に対しては、十分に注意し、慎重に投与を行ってください。 |
|
9.1.2 結核の既往歴を有する患者又は結核感染が疑われる患者 |
本剤の免疫抑制作用により、結核の既往歴を有する患者様では結核を活動化させる可能性がありますので、これらの患者様に対しては、本剤投与中に胸部X線検査等を定期的に行うなど結核の徴候及び症状を注意深く観察しながら、慎重に投与を行ってください。 検査フロー |
|
|
9.1.3 悪性腫瘍の既往歴のある患者、悪性腫瘍を発現し、本剤投与継続を考慮している患者 |
本剤は免疫抑制作用を有することから、悪性腫瘍発現の可能性があります。悪性腫瘍の既往歴のある患者様を対象とする試験は実施されていないことから、本剤を悪性腫瘍の既往歴のある患者様又は悪性腫瘍を発現し、本剤投与継続を考慮している患者様に対しては、本剤使用について十分に検討し、慎重に投与を行ってください。 悪性腫瘍 |
|
|
9.1.4 アレルゲン免疫療法を受けた患者 |
本剤を使用した場合の評価はされていませんが、本剤はアレルゲン免疫療法に影響を与える可能性があるため、使用を検討する場合には十分注意してください。特にアナフィラキシーに対するアレルゲン免疫療法を受けている、又は過去に受けたことのある患者様については十分注意してください。 | |
|
9.5 妊婦 |
妊婦又は妊娠している可能性のある婦人には、治療上の有益性が危険性を上回ると判断される場合にのみ投与してください(妊娠中の投与に関する安全性は確立していません。動物実験で本剤が胎児へ移行することが報告されていますが、胚・胎児毒性及び催奇形性は認められていません)。 | |
|
9.6 授乳婦 |
授乳中の婦人では、治療上の有益性及び母乳栄養の有益性を考慮し、本剤投与中の授乳の継続又は中止を検討してください(動物実験で本剤が乳汁中へ移行することが報告されています)。 | |
|
9.7 小児等 |
小児等に対しての使用経験はなく、低出生体重児、新生児、乳児、幼児及び小児に対する安全性は確立されていません。 | |
|
9.8 高齢者 |
一般に高齢者では、生理機能(免疫機能等)が低下していることにより、副作用が発現しやすくなることが考えられます。患者様の状態を十分に観察し、慎重に投与してください。呼吸器感染症の予防に、インフルエンザワクチン及び肺炎球菌ワクチンの接種が推奨されています。 | |
表中の項目番号は電子化された添付文書に則って記載
その他注意すべき患者様
| 1)生ワクチン接種を希望する患者 | 本剤は生ワクチン接種に起因する感染症発現の可能性を否定できません。 本剤による治療中は、生ワクチンを接種しないでください。 既にワクチンを投与している患者様においては、生ワクチン投与日より4週間以上あけた後、本剤を投与してください。 |
| 2)糖尿病を合併する患者 | 海外臨床試験において、糖尿病を合併する患者様では血清中ウステキヌマブのトラフ濃度が低く、効果が低い傾向がみられました。 |
| 3)免疫抑制剤を投与中の患者、 紫外線療法を行っている患者 |
本剤と免疫抑制剤又は紫外線療法を併用した場合の安全性及び有効性は確立されていません。 |
| 4)免疫不全患者・免疫抑制状態の患者 (AIDS患者等) |
免疫不全患者様・免疫抑制状態の患者様に対しての使用経験はなく、安全性は確立されていません。本剤はIL-12/23の作用を選択的に抑制し、感染症を発現、悪化させる可能性がありますので、免疫不全患者様や免疫抑制状態にある患者様への投与は避けてください。 |
| 5)手術の予定がある患者 | 手術後の創傷治癒、感染防御に影響を及ぼす可能性があります。手術後は創傷が治癒し、感染の合併がないことを確認してから本剤を投与してください。また、外科手術を行う場合には、本剤の最終投与から少なくとも6週間以上の間隔をあけてください。 |
| 6)他の生物学的製剤を最近使用した患者 | 本剤と他の生物学的製剤の併用について安全性及び有効性は確立していないので、併用を避けてください。また他の生物学的製剤から変更する場合は感染症の徴候について患者様の状態を十分に観察してください。 |
インフォームド・コンセント
本剤はIL−12/23の作用を選択的に抑制することから、結核を含む感染症を悪化又は顕在化させる可能性があります。本剤との因果関係は明確ではありませんが悪性腫瘍の発現も報告されています。また、本剤は乾癬を完治させる薬剤ではなく、すべての患者様に効果があらわれるわけではありません。
これらを含めた本剤のリスク及びベネフィットについて患者様にご理解いただき、本剤による治療について同意を得るために、インフォームド・コンセントのポイントについてまとめました。患者様へご説明いただく際、ご活用ください。
インフォームド・コンセントのポイント
| 項目 | 主な説明内容 | |
|---|---|---|
| 乾癬について | 乾癬は、皮膚で起こる慢性の炎症性疾患です。症状が進むと皮疹が増え、全身に及んだりすることもあります。 | |
| 治療について | 症状の軽い方は外用療法(塗り薬)、中等~重症になると紫外線療法や内服療法を行います。症状の改善がみられない場合は、生物学的製剤による注射療法が行われます。 | |
| 乾癬とサイトカインの 関係について |
乾癬は、免疫に関連する物質の過剰な働きがかかわっていることが明らかになってきました。ウステキヌマブBS皮下注45mgシリンジ「F」は、乾癬に深くかかわるIL−12及びIL−23の働きを抑えます。 | |
| ウステキヌマブBS皮下注45mgシリンジ「F」について | 対象患者 | ウステキヌマブBS皮下注45mgシリンジ「F」は、生物学的製剤であるため、適応となる患者様と投与できない患者様がいます。 |
| 投与方法 | 1回目に皮下投与した後、2回目は4週後、3回目以降は12週ごとに1回の間隔で皮下投与します。 | |
| 安全性 | ウステキヌマブBS皮下注45mgシリンジ「F」投与中は、風邪の症状などの副作用があらわれる可能性がありますので、気になる症状があればすぐに医師に相談するように指導してください。特に注意すべき副作用として、アナフィラキシー、結核の再燃、肺炎などの重い感染症、ウイルス性肝炎、間質性肺炎、悪性腫瘍(がん)があります。 | |
投与前に行う確認事項
問診:合併症、既往歴、乾癬に対する治療歴など、十分な問診を行ってください。
検査:結核を含む感染症の有無を確認するために、下記の検査を行ってください。
結核
- 結核既往歴の問診(家族の発症も含む)
- 結核感染の有無を調べる検査
インターフェロン−γ遊離試験又はツベルクリン反応検査 - 結核が発病しているかどうかを調べる検査
胸部画像検査(必須):胸部X線検査、CT検査
B型肝炎ウイルス検査
- HBs抗原、HBs抗体、HBc抗体
上記以外にも、必要に応じてその他の感染症や悪性腫瘍等に関する検査を実施してください。
生物学的製剤治療開始前チェックリスト
乾癬における生物学的製剤の使用ガイダンス(2022年版)では、以下とされています。
(□は必須項目)
| <インフォームドコンセント> | ||
|---|---|---|
| □ パンフレット説明・同意 | 年 月 日 | |
| □ 上記説明者名 |
|
|
| □ 治療開始日 | 年 月 日 | |
| □ 緊急連絡先確認1 | ||
| □ 緊急連絡先確認2 | ||
| <治療前検査項目> | ||
| 血液/尿検査 | ||
| □ WBC |
/μL
|
|
| □ リンパ球 |
/μL
|
|
| □ CRP |
mg/dL
|
|
| □ 血中β-Dグルカン |
pg/mL
|
|
| □ KL-6 |
U/mL
|
|
| □ 抗核抗体*1 |
|
|
| □ 尿一般 |
|
|
| 感染症検査 | ||
| □ HBs抗原 |
陰性 ・ 陽性
|
|
| □ HBs抗体 |
陰性 ・ 陽性
|
|
| □ HBc抗体 |
陰性 ・ 陽性
|
|
| □ HBV-DNA定量 |
20IU/mL未満・20IU/mL以上
|
|
|
上記抗体陽性の場合
|
||
| □ HCV抗体 |
陰性 ・ 陽性
|
|
| □ HIV抗体 |
陰性 ・ 陽性
|
|
| □ HTLV-Ⅰ抗体 |
陰性 ・ 陽性
|
|
| 結核検査 | ||
| □ ツベルクリン反応*2 | ||
| 注射部位 |
|
|
| 注射日 |
/
|
|
| 判定日 |
/
|
|
| □ 判定 |
陰性 ・ 陽性 ・ 強陽性
|
|
| 発赤 |
× mm
|
|
| 硬結 |
無 ・ 有
|
|
| 水疱 |
無 ・ 有
|
|
| 二重発赤 |
無 ・ 有
|
|
| 壊死 |
無 ・ 有
|
|
| □ IGRA(クオンティフェロン検査/T-SPOT検査)*2 |
|
|
| 画像検査 | ||
| □ 胸部X線*3 |
|
|
| □ 胸部CT*3 |
|
|
| <問診事項> | ||
| □ 本剤(およびタンパク製剤)等に過敏症の既往 |
無 ・ 有
|
|
| □ 脱髄疾患の既往(家族歴) |
無 ・ 有
|
|
| □ アレルギー歴 |
|
無 ・ 有
|
| □ 感染症 |
|
無 ・ 有
|
| □ 悪性腫瘍 |
|
無 ・ 有
|
| □ 糖尿病 |
無 ・ 有
|
|
| □ うっ血性心不全 |
無 ・ 有
|
|
| □ 間質性肺炎 |
無 ・ 有
|
|
| □ 活動性結核 |
無 ・ 有
|
|
| □ 結核患者(家族・職場)との接触歴 |
無 ・ 有
|
|
| □ 結核感染歴 |
無 ・ 有
|
|
| □ 結核治療歴 |
無 ・ 有
|
|
| □ それ以外の呼吸器疾患 |
|
無 ・ 有
|
| □ 妊娠 |
無 ・ 有
|
|
| □ ワクチン接種 |
|
無 ・ 有
|
| □ 紫外線治療歴 |
無 ・ 有
|
|
|
J/cm2
|
||
|
回
|
||
|
年
|
||
| □ シクロスポリン治療歴 |
mg/日 年
|
無 ・ 有
|
*1 抗核抗体検査はTNF阻害薬使用時に行う.
*2 どちらか一方を必須とするが,IGRA(クオンティフェロン検査/T-SPOT検査)を優先する.
*3 どちらか一方を必須とする.
日本皮膚科学会乾癬分子標的薬安全性検討委員会.:日皮会誌.;132(10):271-96. 2022.
結核 下図 検査フロー
ウステキヌマブBS皮下注45mgシリンジ「F」 電子化された添付文書(抜粋)
8.重要な基本的注意
8.2本剤投与に先立って結核に関する十分な問診及び胸部X線検査に加え、インターフェロン−γ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。また、本剤投与中も、胸部X線検査等の適切な検査を定期的に行うなど結核症の発現には十分に注意し、結核を疑う症状(持続する咳、体重減少、発熱等)が発現した場合には速やかに担当医に連絡するよう患者に指導すること。[1.1、1.3、2.2、9.1.2、11.1.3 参照]
9.特定の背景を有する患者に関する注意
9.1合併症・既往歴等のある患者
9.1.2結核の既往歴を有する患者又は結核感染が疑われる患者
| (1) | 結核の既往歴を有する患者では、結核を活動化させるおそれがある。[1.1、1.3、8.2、11.1.3 参照] |
|---|---|
| (2) | 結核の既往歴を有する場合又は結核感染が疑われる場合には、結核の診療経験がある医師に相談すること。下記のいずれかの患者には、結核等の感染症について診療経験を有する医師と連携の下、原則として本剤の投与開始前に適切な抗結核薬を投与すること。[1.1、1.3、 8.2、 11.1.3 参照]
|
生物学的製剤投与時の結核予防対策
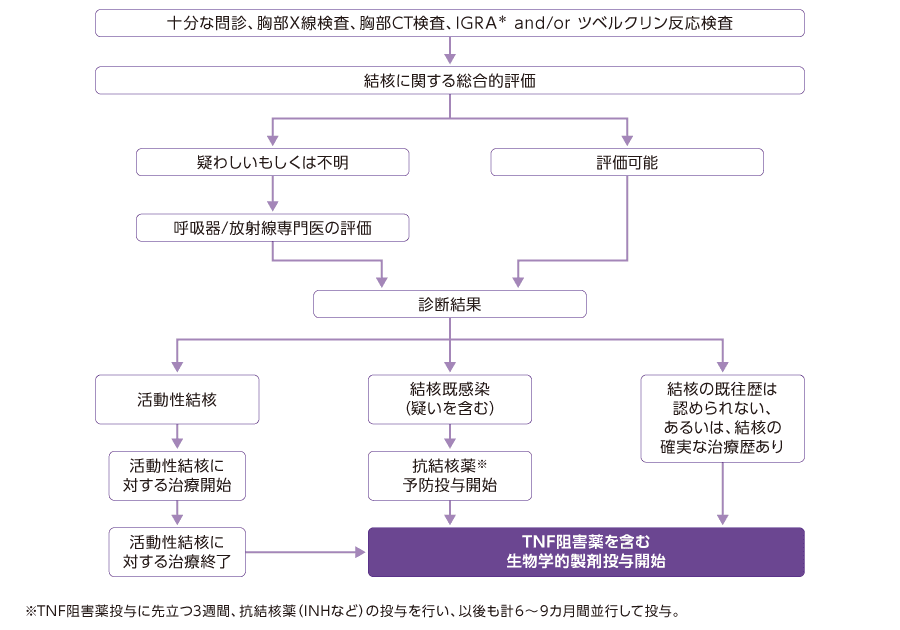
*IGRA:インターフェロン-γ遊離試験(interferon-gamma release assay)
日本呼吸器学会 炎症性疾患に対する生物学的製剤と呼吸器疾患 診療の手引き 第2版作成委員会編
「炎症性疾患に対する生物学的製剤と呼吸器疾患 診療の手引き(第2版)」 2020年4月 P.68
B型肝炎ウイルス検査
HBV既往感染例では、低レベルながらHBV−DNAの複製が長期間持続しており、生物学的製剤をはじめとする強力な免疫抑制薬の使用によって再活性化し、重症肝炎が発症することが報告されています。このような経緯から、日本肝臓学会 肝炎診療ガイドライン作成委員会による「免疫抑制・化学療法により発症するB型肝炎対策ガイドライン1)」が作成されています。免疫抑制・化学療法を施行しているすべての症例で、HBs抗原を測定し、HBVキャリアのスクリーニングをしてください。HBs抗原陰性の場合であっても、HBs抗体、HBc抗体を測定し、既往感染者かどうかの確認をお願いします。既往感染者の場合は、HBV−DNAをスクリーニングしてください。既往感染者で治療開始後及び治療内容の変更後(中止を含む)は、定期的なHBV−DNA量のモニタリングが推奨されています。
日本肝臓学会 肝炎診療ガイドライン作成委員会 編.:B型肝炎治療ガイドライン(第4版). 2022年6月.
投与後のチェック項目免疫抑制・化学療法により発症するB型肝炎対策ガイドライン①
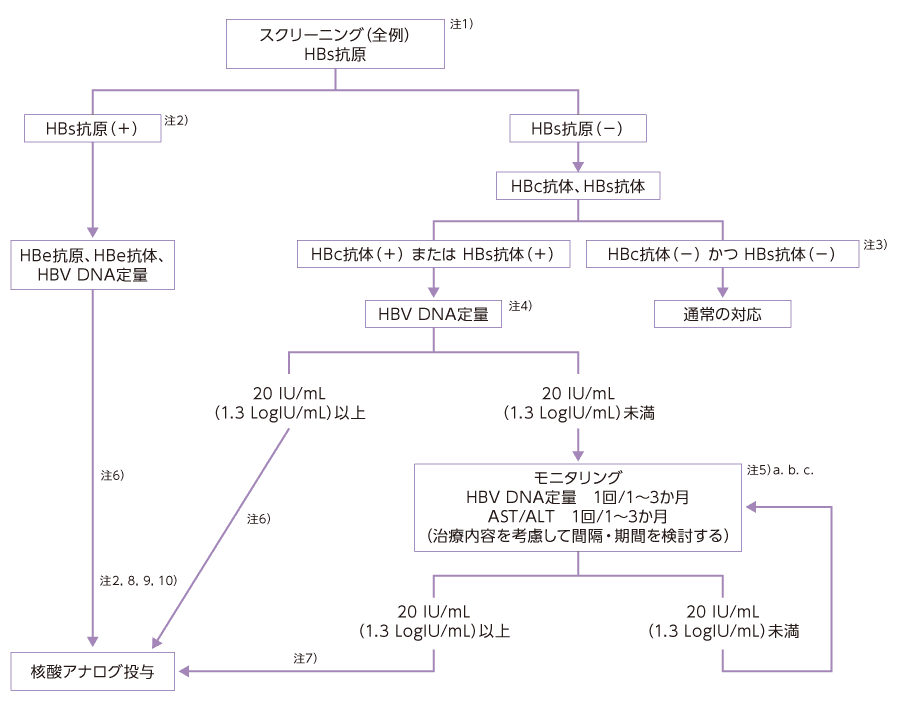
日本肝臓学会 肝炎診療ガイドライン作成委員会 編.:B型肝炎治療ガイドライン(第4版). 2022年6月.
免疫抑制・化学療法により発症するB型肝炎対策ガイドライン②
| 補足: | 血液悪性疾患に対する強力な化学療法中あるいは終了後に、HBs抗原陽性あるいはHBs抗原陰性例の一部においてHBV再活性化によりB型肝炎が発症し、その中には劇症化する症例があり、注意が必要である。また、血液悪性疾患または固形癌に対する通常の化学療法およびリウマチ性疾患・膠原病などの自己免疫疾患に対する免疫抑制療法においてもHBV再活性化のリスクを考慮して対応する必要がある。通常の化学療法および免疫抑制療法においては、HBV再活性化、肝炎の発症、劇症化の頻度は明らかでなく、ガイドラインに関するエビデンスは十分ではない。また、核酸アナログ投与による劇症化予防効果を完全に保証するものではない。 | ||||||
|---|---|---|---|---|---|---|---|
| 注1) | 免疫抑制・化学療法前に、HBVキャリアおよび既往感染者をスクリーニングする。HBs抗原、HBc抗体およびHBs抗体を測定し、HBs抗原が陽性のキャリアか、HBs抗原が陰性でHBs抗体、HBc抗体のいずれか、あるいは両者が陽性の既往感染かを判断する。 HBs抗原・HBc抗体およびHBs抗体の測定は、高感度の測定法を用いて検査することが望ましい。また、HBs抗体単独陽性(HBs抗原陰性かつHBc抗体陰性)例においても、HBV再活性化は報告されており、ワクチン接種歴が明らかである場合を除き、ガイドラインに従った対応が望ましい。 |
||||||
| 注2) | HBs抗原陽性例は肝臓専門医にコンサルトすること。また、すべての症例において核酸アナログの投与開始ならびに終了にあたって肝臓専門医にコンサルトするのが望ましい。 | ||||||
| 注3) | 初回化学療法開始時にHBc抗体、HBs抗体未測定の再治療例および既に免疫抑制療法が開始されている例では、抗体価が低下している場合があり、HBV DNA定量検査などによる精査が望ましい。 | ||||||
| 注4) | 既往感染者の場合は、リアルタイムPCR法によりHBV DNAをスクリーニングする。 | ||||||
| 注5) |
|
||||||
| 注6) | 免疫抑制・化学療法を開始する前、できるだけ早期に核酸アナログ投与を開始する。ことに、ウイルス量が多いHBs抗原陽性例においては、核酸アナログ予防投与中であっても劇症肝炎による死亡例が報告されており、免疫抑制・化学療法を開始する前にウイルス量を低下させておくことが望ましい。 | ||||||
| 注7) | 免疫抑制・化学療法中あるいは治療終了後に、HBV DNA量が20 IU/mL(1.3 LogIU/mL)以上になった時点で直ちに核酸アナログ投与を開始する(20 IU/mL未満陽性の場合は、別のポイントでの再検査を推奨する)。また、高感度HBs抗原モニタリングにおいて1 IU/mL未満陽性(低値陽性)あるいは高感度HBコア関連抗原陽性の場合は、HBV DNAを追加測定して20 IU/mL以上であることを確認した上で核酸アナログ投与を開始する。免疫抑制・化学療法中の場合、免疫抑制薬や免疫抑制作用のある抗腫瘍薬は直ちに投与を中止するのではなく、対応を肝臓専門医と相談する。 | ||||||
| 注8) | 核酸アナログは薬剤耐性の少ないETV、TDF、TAFの使用を推奨する。 | ||||||
| 注9) | 下記の①か②の条件を満たす場合には核酸アナログ投与の終了が可能であるが、その決定については肝臓専門医と相談した上で行う。
|
||||||
| 注10) | 核酸アナログ投与終了後少なくとも12か月間は、HBV DNAモニタリングを含めて厳重に経過観察する。経過観察方法は各核酸アナログの使用上の注意に基づく。経過観察中にHBV DNA量が20 IU/mL(1.3 LogIU/mL)以上になった時点で直ちに投与を再開する。 |
日本肝臓学会 肝炎診療ガイドライン作成委員会 編.:B型肝炎治療ガイドライン(第4版). 2022年6月.

