
臨床成績
海外第Ⅲ相臨床試験:治療学的同等性検証試験(海外データ)1)
本剤は、海外第Ⅲ相臨床試験から得られた結果を外挿して承認されました。そのため、一部、国内で承認された用法及び用量とは異なる症例が含まれています。
| 目的 | 中等症から重症の慢性尋常性乾癬患者を対象として、本剤と先行バイオ医薬品(EU)の治療学的同等性を実証する。 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 試験デザイン | 二重盲検、無作為化、多施設共同臨床試験 | |||||||||||
| 対象 | 中等症から重症の慢性尋常性乾癬患者 581例 | |||||||||||
| 主な選択基準 | 中等症から重症の慢性尋常性乾癬患者(罹病期間:6ヵ月以上)と診断され、18歳以上75歳未満で、スクリーニング時及びベースライン時に乾癬病変に関連した体表面積(%BSA)が10%以上、PASIスコアが12以上、治験責任医師等による静的全般評価(sPGA)が3(中等症)以上で、2ヵ月以上乾癬の病状が安定している男女の患者を組み入れた。 | |||||||||||
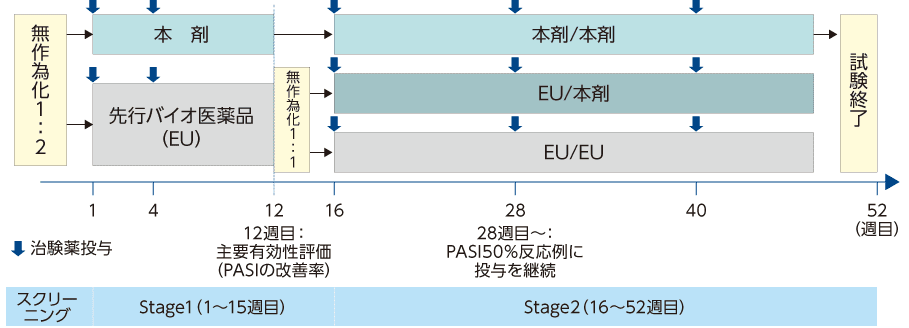
| 試験方法 |
本試験は以下の2つのstageで構成され、Stage 1では15週目まで二重盲検下で主要有効性の評価を、以後のStage 2では52週目まで二重盲検下で長期有効性及び安全性の評価を行った。 Stage 1(15週目まで)
Stage 2(16週目~52週目まで)
|
|||||||||||
| 評価項目 |
|
|||||||||||
| 解析計画 |
主要評価項目の解析は実施計画書に適合した対象集団(PPS)に基づき実施された。また、主要解析の頑健性を検証するために、16週目までのITT集団を対象に主要評価項目の同等性検定も実施した。ITT集団は、無作為化後に割り付けられた治験薬を1回以上投与されたすべての被験者とした。安全性解析対象集団は、無作為化後に割り付けられた治験薬を1回以上投与されたすべての被験者とし、実際に投与された治験薬に基づいて割付けを行った。 [有効性の解析]
[免疫原性解析] ADA及びnAbの有無を投与群及び来院ごとに集計した。また、ADA陽性の抗体価も集計した。 [安全性の解析] 有害事象はICH国際医薬用語集(MedDRA) version 25.1を用いてコーディングし、器官別大分類(SOC)及び基本語(PT)別に集計した。 |
|||||||||||
【本邦で承認された用法及び用量】
6.用法及び用量
通常、成人にはウステキヌマブ(遺伝子組換え)[ウステキヌマブ後続1]として1回45mgを皮下投与する。初回投与及びその4週後に投与し、以降12週間隔で投与する。ただし、効果不十分な場合には1回90mgを投与することができる。
Stage1(15週目)までの結果(有効性・免疫原性・薬物動態)
患者背景(PPS)
| 本剤群 (n=194) |
EU−先行バイオ医薬品群 (n=383) |
||
|---|---|---|---|
| 年齢 | 歳,平均値±標準偏差 | 42.3±12.96 | 42.3±12.96 |
| 性別 | 男性/女性,n(%) | 107(55.2)/87(44.8) | 255(66.6)/128(33.4) |
| 人種 | 白人,n(%) | 194(100.0) | 383(100.0) |
| 体重 | kg,平均値±標準偏差 | 83.48±18.368 | 84.20±18.606 |
| ≦80kg,n(%) | 84(43.3) | 166(43.3) | |
| >80kg,≦100kg,n(%) | 80(41.2) | 158(41.3) | |
| >100kg,n(%) | 30(15.5) | 59(15.4) | |
| BMI | kg/m2, 平均値±標準偏差 | 28.08±5.334 | 27.75±5.493 |
| 生物学的製剤の投与歴 | あり,n(%) | 15(7.7) | 29(7.6) |
| 罹病期間 | カ月,平均値±標準偏差 | 193.4±139.86 | 199.8±135.68 |
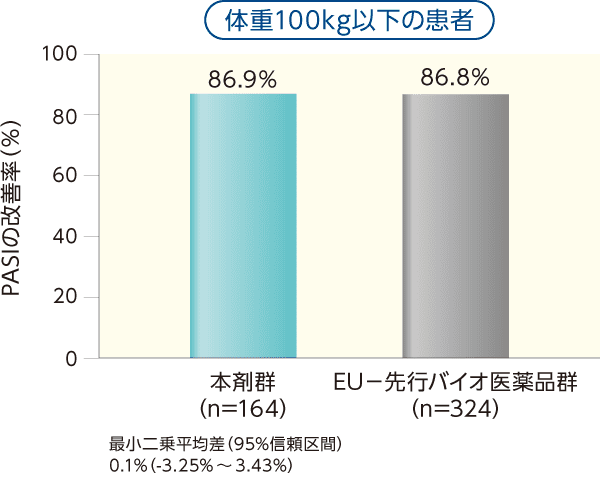
ベースラインから12週目までのPASIの改善率(主要評価項目)
主たる解析対象集団である体重100kg以下の患者においては、本剤群86.9%、EU-先行バイオ医薬品群86.8%で、最小二乗平均差の95%信頼区間は-3.25% ~ 3.43%であった。
体重100kg以下の患者群(PPS)において事前に規定した同等性許容範囲内であり、本剤とEU-先行バイオ医薬品の臨床的同等性が証明された。
ベースラインから12週目までのPASIの改善率(主要評価項目)(PPS)
| 体重100kg以下の患者 | ||
|---|---|---|
| 本剤群 (n=164) |
EU−先行バイオ医薬品群 (n=324) |
|
| 最小二乗平均値 (標準誤差) |
86.9(1.91) | 86.8(1.64) |
| 最小二乗平均差 (標準誤差) |
0.1(1.70) | |
| 95%信頼区間 | -3.25, 3.43 | |
※体重100kg超の投与群は、承認外の用量のため、削除しています。
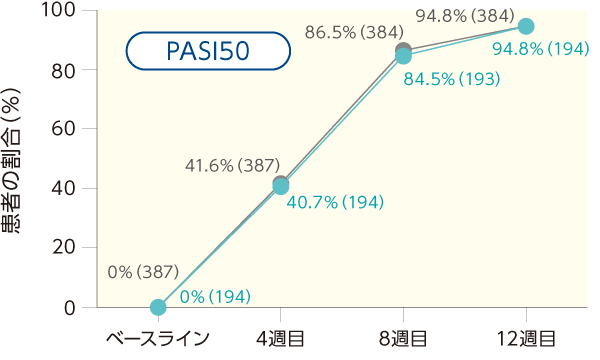
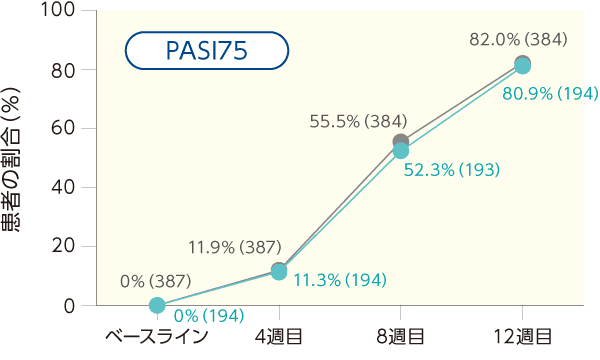
PASI(副次評価項目)
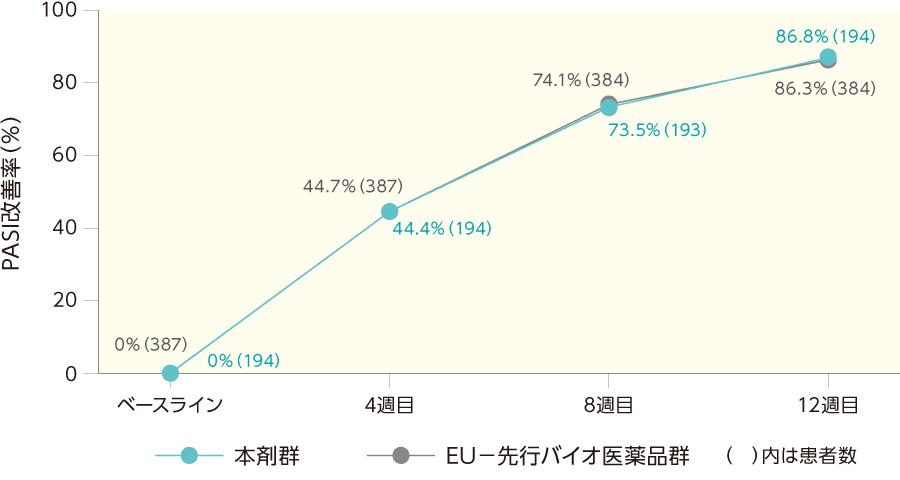
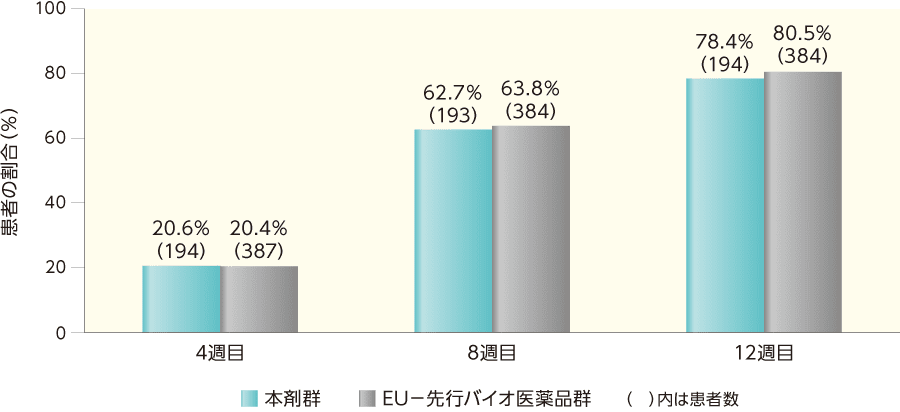
PASI50、PASI75、PASI90、PASI100を達成した患者の割合について、両群間で臨床的に意味のある差は認められなかった。また、Stage 1のベースラインからのPASI改善率も本剤群及びEU−先行バイオ医薬品群で同様で、経時的に増加した。
PASI50、PASI75、PASI90、PASI100を達成した患者の割合の推移(ITT集団)
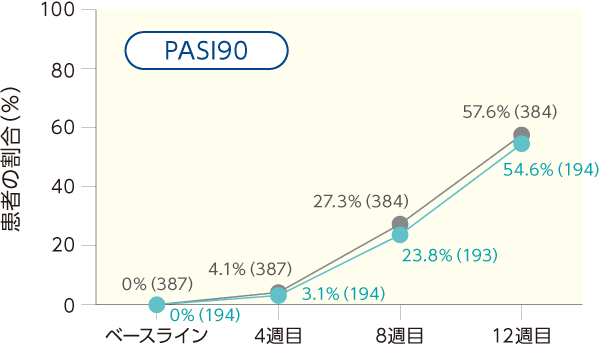
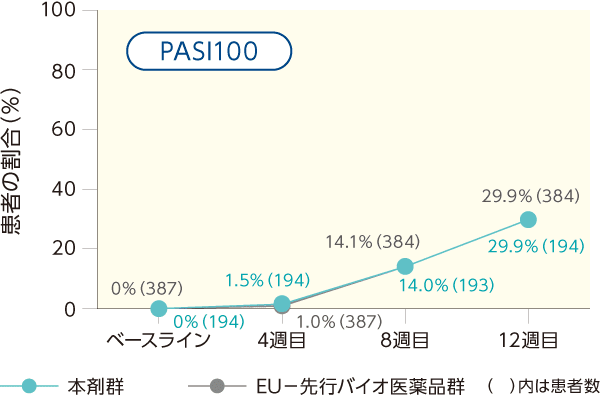
PASI改善率の推移(ITT集団)
sPGAスコア(副次評価項目)
ベースラインから16週目までの各時点における「消失」又は「ほぼ消失」を達成した患者の割合は投与群間で同様であった。
sPGAで「消失」又は「ほぼ消失」を達成した患者の割合(ITT集団)
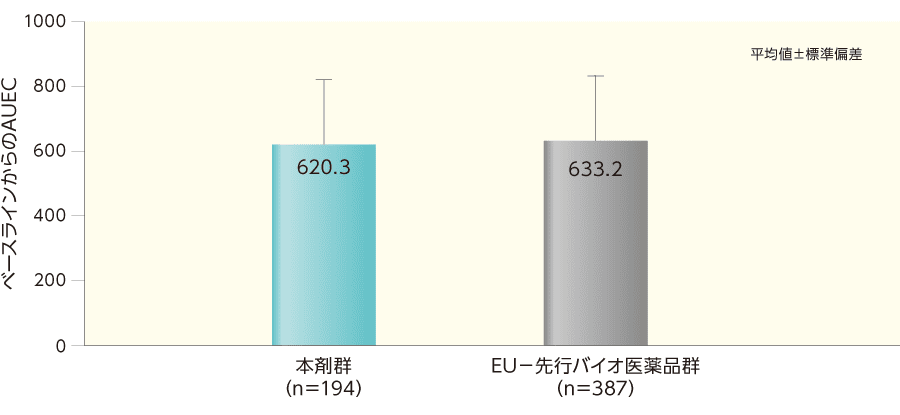
PASIの効果曲線下面積(AUEC)(副次評価項目)
ベースラインから12週目までのAUECは投与群間で同程度であった。
ベースラインから12週目までのAUEC(ITT集団)
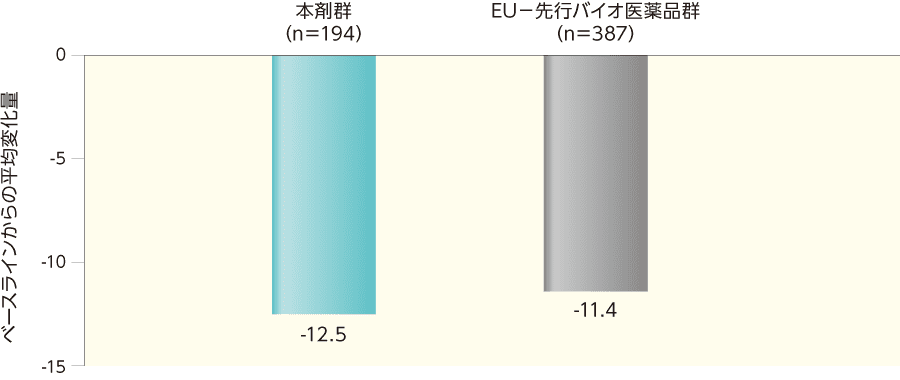
DLQI(副次評価項目)
Stage1のベースラインからのDLQIの変化は投与群間で類似していた。
DLQIスコアの12週目におけるベースラインからの平均変化量(ITT集団)
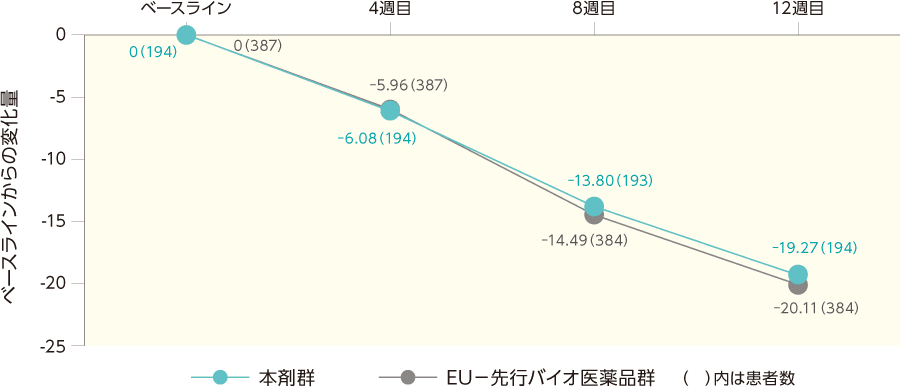
%BSA(副次評価項目)
Stage1の各時点におけるベースラインからの%BSAの変化は、投与群間で差がみられなかった。
%BSAのベースラインからの変化量の推移(ITT集団)
ADA発現率・nAb発現率(副次評価項目)
16週目までのADA発現率は本剤投与群で28.4%、EU−先行バイオ医薬品群で54.5%であった。また、nAb発現率は本剤投与群で27.3%、EU−先行バイオ医薬品群で32.2%であった。
Ctrough(副次評価項目)
Stage1のベースラインから16週目までの平均Ctroughは投与群間で同程度であり、臨床的に意味のある差は認められなかった。体重100kg以下の患者でも、いずれの項目に関してもITT集団と同様の結果が認められた。
Stage2(16週目~52週目まで)までの結果(有効性・免疫原性・薬物動態)
PASI(副次評価項目)
経時的なPASI50、PASI75、PASI90、PASI100を達成した患者の割合について、投与群間で臨床的に意味のある差は認められなかった。また、PASI改善率は投与群間で同様で、Stage 2においても経時的に増加した。
PASI50、PASI75、PASI90、PASI100を達成した患者の割合(ITT集団)

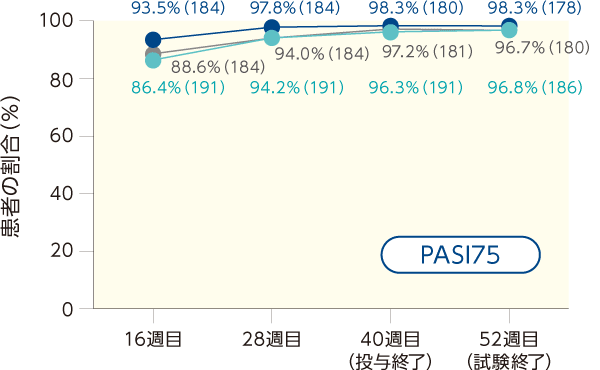

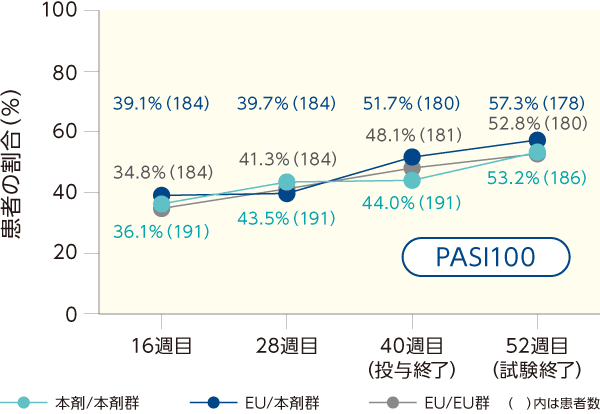
PASI改善率の推移(ITT集団)
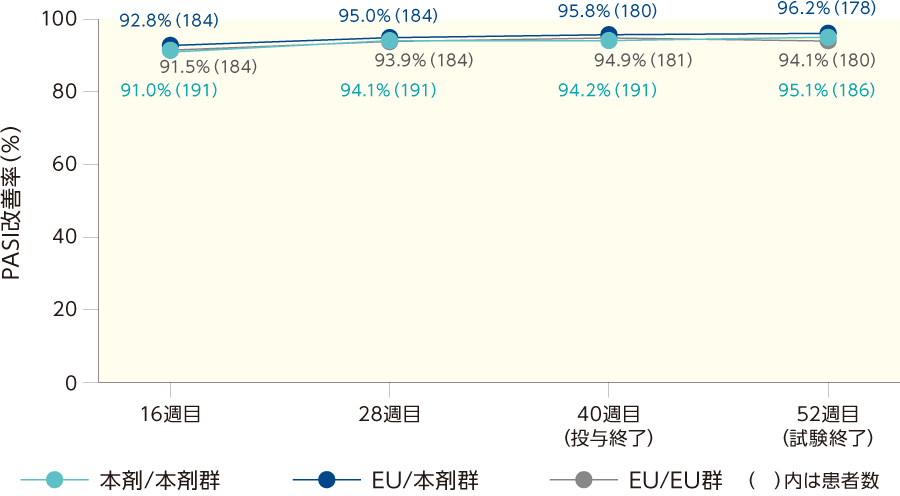
sPGAスコア(副次評価項目)
16週目から52週目までの各時点における「消失」又は「ほぼ消失」を達成した患者の割合は投与群間で同様であり、各時点におけるsPGAの変化は投与群間で類似していた。
sPGAで「消失」又は「ほぼ消失」を達成した患者の割合
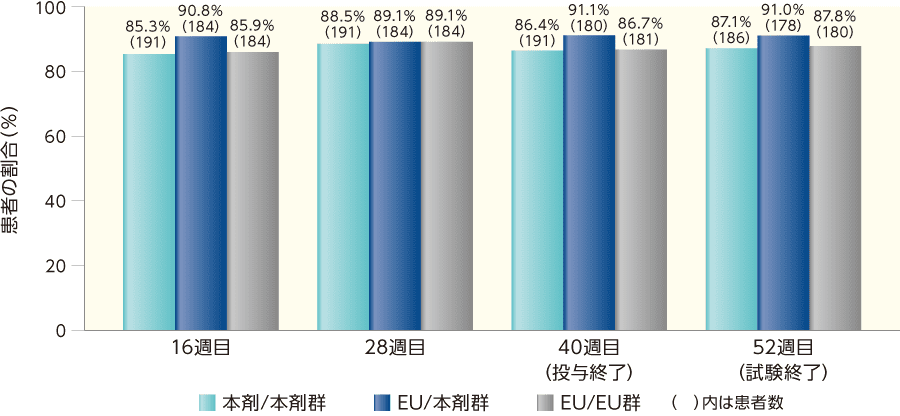
DLQI(副次評価項目)
Stage2のベースラインからのDLQIの変化は投与群間で類似していた。
DLQIの変化量の推移(ITT集団)
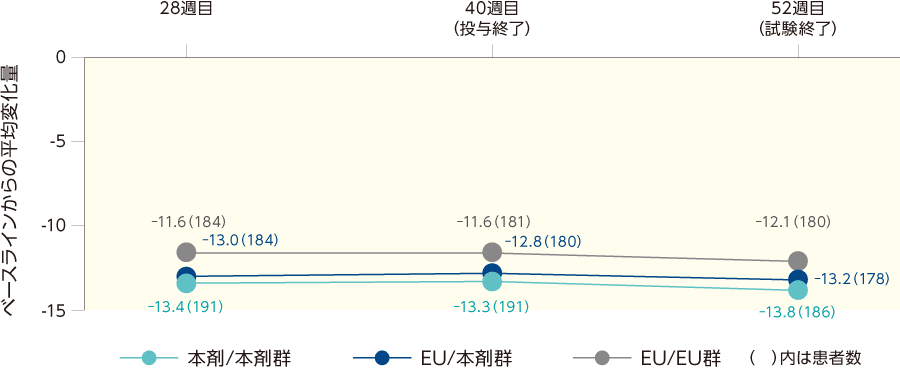
%BSA(副次評価項目)
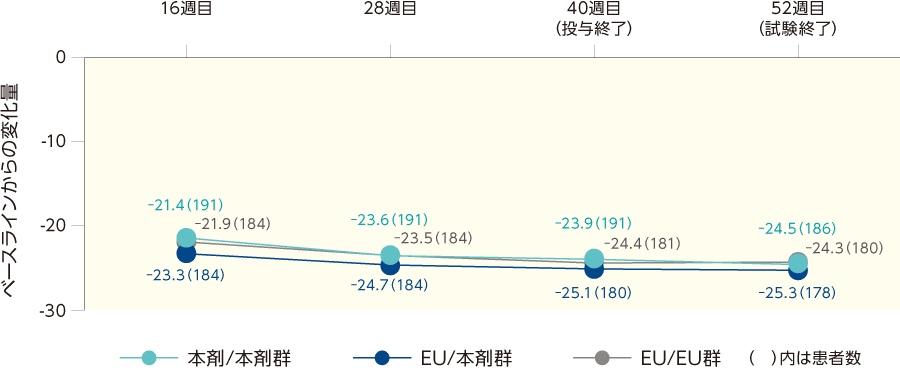
Stage 2の各時点におけるベースラインからの%BSAの変化は、投与群間で差がみられなかった。
%BSAの変化量の推移(ITT集団)
ADA発現率・nAb発現率(副次評価項目)
試験全体としてのADA発現率(52週目までのいずれかの来院日でADA陽性)は本剤/本剤群で38.7%、EU/本剤群で64.1%、EU/EU群で58.2%であった。また、nAb発現率(52週目までのいずれかの来院日でnAb陽性)は本剤/本剤群で32.4%、EU/本剤群で36.4%、EU/EU群で28.0%であった。
Ctrough
Stage 2でも52週目までのCtrough値はすべての投与群間で同程度であった。
体重100kg以下の患者でも、いずれの項目に関してもITT集団と同様の結果が認められた。
安全性
Stage1(15週目まで)
本剤群で有害事象が194例中67例(34.5%)104件、副作用が10例(5.2%)13件報告され、EU−先行バイオ医薬品群はそれぞれ387例中130例(33.6%)223件、37例(9.6%)39件で同様であった。主な副作用は、上気道感染 本剤群3例(1.5%)、EU−先行バイオ医薬品群7例(1.8%))および注射部位反応(各2例(1.0%)、9例(2.3%))であった。16週目までに重篤な副作用、および投与中止、死亡に至った副作用は報告されなかった。
Stage2(16週目~28週目まで)
本剤/本剤群で有害事象が193例中21例(10.9%)26件、EU/本剤群で192例中30例(15.6%)35件、EU/EU群で189例中29例(15.3%)36件報告された。副作用は本剤/本剤群では認められず、EU/本剤群では5例(2.6%)5件、EU/EU群では2例(1.1%)2件報告された。主な副作用は、注射部位反応(本剤/本剤群0例、EU/本剤群1例(0.5%)、EU/EU群1例(0.5%))であった。16週目~28週目までに重篤な副作用、および投与中止、死亡に至った副作用は報告されなかった。
Stage3(28週目~52週目まで)
本剤/本剤群で有害事象が191例中32例(16.8%)49件、EU/本剤群で184例中42例(22.8%)66件、EU/EU群で184例中39例(21.2%)49件報告された。副作用は本剤/本剤群では認められず、EU/本剤群では3例(1.6%)4件、EU/EU群では6例(3.3%)8件報告された。主な副作用は、注射部位反応(本剤/本剤群0例、EU/本剤群1例(0.5%)、EU/EU群2例(1.1%))であった。28週目~ 52週目までに重篤な副作用、および投与中止、死亡に至った副作用は報告されなかった。
全患者群又は体重100kg以下の患者の投与群間で顕著な不均衡は認められなかった。
海外第Ⅲ相臨床試験における副作用発現状況(15週目まで)
| 副作用 | 本剤群 (n=194) |
EU−先行バイオ医薬品群 (n=387) |
||
|---|---|---|---|---|
| 発現例数(%) | 件数 | 発現例数(%) | 件数 | |
| 全ての副作用 | 10(5.2) | 13 | 37(9.6) | 39 |
| 感染症及び寄生虫症 | 6(3.1) | 6 | 14(3.6) | 14 |
| 上気道感染 | 3(1.5) | 3 | 7(1.8) | 7 |
| 上咽頭炎 | 2(1.0) | 2 | 3(0.8) | 3 |
| 単純ヘルペス | 0 | 0 | 1(0.3) | 1 |
| 口腔ヘルペス | 0 | 0 | 1(0.3) | 1 |
| 咽頭炎 | 1(0.5) | 1 | 0 | 0 |
| 鼻炎 | 0 | 0 | 1(0.3) | 1 |
| 副鼻腔炎 | 0 | 0 | 1(0.3) | 1 |
| 一般・全身障害及び投与部位の状態 | 2(1.0) | 3 | 12(3.1) | 13 |
| 注射部位反応 | 2(1.0) | 3 | 9(2.3) | 9 |
| 注射部位疼痛 | 0 | 0 | 1(0.3) | 2 |
| 無力症 | 0 | 0 | 1(0.3) | 1 |
| 注射部位血腫 | 0 | 0 | 1(0.3) | 1 |
| 皮膚及び皮下組織障害 | 0 | 0 | 6(1.6) | 6 |
| そう痒症 | 0 | 0 | 3(0.8) | 3 |
| ざ瘡 | 0 | 0 | 1(0.3) | 1 |
| アレルギー性皮膚炎 | 0 | 0 | 1(0.3) | 1 |
| 乾癬 | 0 | 0 | 1(0.3) | 1 |
| 神経系障害 | 0 | 0 | 3(0.8) | 3 |
| 頭痛 | 0 | 0 | 2(0.5) | 2 |
| 傾眠 | 0 | 0 | 1(0.3) | 1 |
| 胃腸障害 | 1(0.5) | 1 | 1(0.3) | 1 |
| 下痢 | 0 | 0 | 1(0.3) | 1 |
| 歯の浸食 | 1(0.5) | 1 | 0 | 0 |
| 血管障害 | 0 | 0 | 2(0.5) | 2 |
| 血腫 | 0 | 0 | 2(0.5) | 2 |
| 心臓障害 | 1(0.5) | 1 | 0 | 0 |
| 不整脈 | 1(0.5) | 1 | 0 | 0 |
| 代謝及び栄養障害 | 1(0.5) | 1 | 0 | 0 |
| 食欲減退 | 1(0.5) | 1 | 0 | 0 |
| 呼吸器、胸郭及び縦隔障害 | 1(0.5) | 1 | 0 | 0 |
| 口腔咽頭痛 | 1(0.5) | 1 | 0 | 0 |
MedDRA/J Ver. 25.1
海外第Ⅲ相臨床試験における副作用発現状況(16~28週目)
| 副作用 | 本剤群 (n=193) |
EU/本剤群 (n=192) |
EU/EU群 (n=189) |
|||
|---|---|---|---|---|---|---|
| 発現例数(%) | 件数 | 発現例数(%) | 件数 | 発現例数(%) | 件数 | |
| 全ての副作用 | 0 | 0 | 5(2.6) | 5 | 2(2.1) | 2 |
| 一般・全身障害及び投与部位の状態 | 0 | 0 | 2(1.0) | 2 | 1(0.5) | 1 |
| 注射部位反応 | 0 | 0 | 1(0.5) | 1 | 1(0.5) | 1 |
| 注射部位血腫 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 感染症及び寄生虫症 | 0 | 0 | 2(1.0) | 2 | 0 | 0 |
| COVID-19 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 上気道感染 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 肝胆道系障害 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 高トランスアミナーゼ血症 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 臨床検査 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| アラニンアミノトランス フェラーゼ増加 |
0 | 0 | 0 | 0 | 1(0.5) | 1 |
MedDRA/J Ver. 25.1
海外第Ⅲ相臨床試験における副作用発現状況(28~52週目)
| 副作用 | 本剤群 (n=191) |
EU/本剤群 (n=184) |
EU/EU群 (n=184) |
|||
|---|---|---|---|---|---|---|
| 発現例数(%) | 件数 | 発現例数(%) | 件数 | 発現例数(%) | 件数 | |
| 全ての副作用 | 0 | 0 | 3(1.6) | 4 | 6(3.3) | 8 |
| 一般・全身障害及び投与部位の状態 | 0 | 0 | 2(1.1) | 3 | 2(1.1) | 2 |
| 注射部位反応 | 0 | 0 | 1(0.5) | 2 | 2(1.1) | 2 |
| 注射部位疼痛 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 感染症及び寄生虫症 | 0 | 0 | 1(0.5) | 1 | 2(1.1) | 2 |
| COVID-19 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 上咽頭炎 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| 上気道感染 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| 臨床検査 | 0 | 0 | 0 | 0 | 1(0.5) | 3 |
| アラニンアミノトランス フェラーゼ増加 |
0 | 0 | 0 | 0 | 1(0.5) | 1 |
| アスパラギン酸アミノ トランスフェラーゼ増加 |
0 | 0 | 0 | 0 | 1(0.5) | 1 |
| γ-グルタミルトランス フェラーゼ増加 |
0 | 0 | 0 | 0 | 1(0.5) | 1 |
| 筋骨格系及び結合組織障害 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| 筋肉痛 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
MedDRA/J Ver. 25.1
1)Steven R Feldman et al., Expert Opin Biol Ther. 2023;23(8):759-771

