
起こりうる副作用とその対策
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行ってください。
重大な副作用
(1)アナフィラキシー(発現頻度:不明)
アナフィラキシー(発疹、蕁麻疹、血管浮腫等)があらわれることがあります。
本剤投与時に観察すること
(2)重篤な感染症(発現頻度:1~ 5%未満)
ウイルス、細菌あるいは真菌による重篤な感染症(蜂巣炎、憩室炎、骨髄炎、胃腸炎、肺炎及び尿路感染等)があらわれることがあります。重篤な感染症が発現した場合には、感染が回復するまで本剤の投与をしないでください。
代表的な症状
- 発熱、咳、呼吸困難などの症状があらわれます。
対処方法
- 発熱、咳、呼吸困難などの症状が出現した場合は、フローチャート(下図)に従って診断を行い、各感染症に応じた抗菌剤治療を行ってください。
- 本剤の投与は中止し、感染症が消失するまで再投与しないでください。
- 高齢者、肺疾患を有する患者様、ステロイドを服用している患者様など、重篤な感染症を発症するリスクが高いと考えられる患者様には、ST合剤などの積極的な予防投与を考慮してください。
投与中の注意事項
- 十分な観察及び問診を行い、投与中は感染症の徴候に十分注意してください。
生物学的製剤、JAK阻害薬投与中における発熱、咳、呼吸困難に対するフローチャート
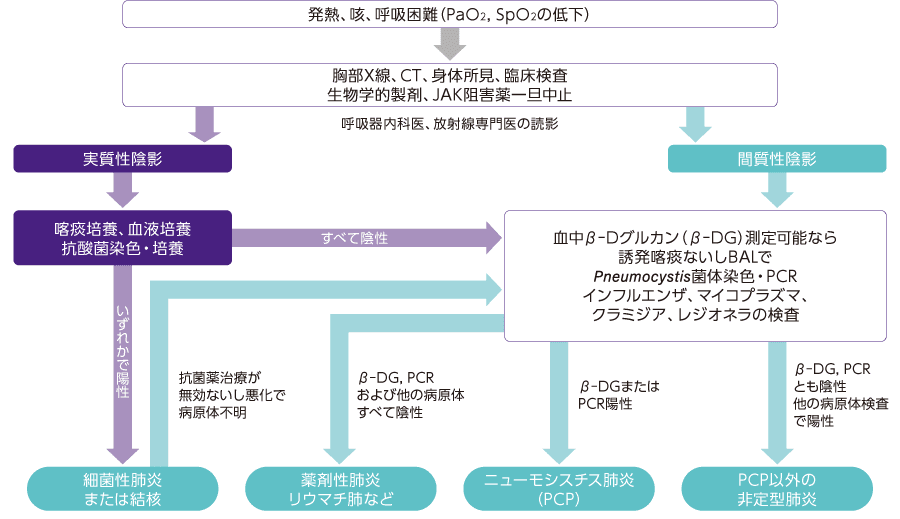
日本リウマチ学会.:関節リウマチ(RA)に対するTNF阻害薬使用の手引き(2022年10月23日改訂版)
詳細は日本リウマチ学会ホームページをご参照ください。
(3)結核(発現頻度:不明)
胸部画像検査等の適切な検査を定期的に行うなど、結核の徴候及び症状*に注意し、結核の症状が疑われる場合には、結核の診療経験のある医師に相談してください。
また、患者様に対しても結核の症状が疑われる場合には、速やかに担当医師に連絡するようご指導ください。
*結核初期の臨床症状は、全くの無症状から重度の呼吸不全までさまざまですが、全身症状としては、発熱・全身倦怠感・体重減少などを呈し、呼吸器症状としては、咳・喀痰・血痰・胸痛・呼吸困難などを呈します。
結核が発現又は再活性化する可能性があります。
代表的な症状
- 結核の代表的な症状として、2週間以上続く咳、痰、微熱が挙げられます。食欲不振、倦怠感、急激な体重の減少などの症状もみられます。進行すると、血痰、喀血、呼吸困難などの症状を伴うこともあります。
対処方法
- 結核の疑いのある患者様には、本剤投与前にあらかじめ結核に対する治療を行ってください。本剤投与開始3週間前より、イソニアジドを原則300mg/日、通常は6ヵ月間、糖尿病の合併や免疫抑制状態が想定される場合は9ヵ月間経口投与してください。
- 結核に対する治療については、呼吸器内科医、放射線専門医、感染症専門医などの専門医と連携しながら行ってください。
投与中の注意事項
- 結核感染の有無を確認するため、必要に応じて定期的(6ヵ月ごと)に胸部X線検査などを行ってください。
(4)間質性肺炎(発現頻度:不明)
本剤投与例において、間質性肺炎の発現が報告されています。また、間質性肺炎の既往を有する患者様における間質性肺炎の再燃が報告されています。
対処方法
- 間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行ってください。
投与中の注意事項
- 咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施してください。
- 高齢者、間質性肺炎の既往例又は合併症を有する患者様においては、定期的に問診を行うなど、注意してください。
悪性腫瘍
本剤はIL−12/23の作用を選択的に抑制する薬剤であり、悪性腫瘍発現の可能性があり、皮膚及び皮膚以外の悪性腫瘍の発現が報告されています。本剤との因果関係は明確ではありませんが、悪性腫瘍の発現には注意してください。
海外の尋常性乾癬、関節症性乾癬、クローン病(承認外効能・効果)、潰瘍性大腸炎(承認外効能・効果)を対象と した臨床試験(第Ⅱ相及び第Ⅲ相試験)において、プラセボ対照期間の非黒色腫皮膚癌を除く悪性腫瘍の発現頻度は、本剤投与群が0.11/100人年(1例/929人年)、プラセボ投与群が0.23/100人年(1例/434人年)でした。非黒色腫皮膚癌の発現頻度は、本剤投与群が0.43/100人年(4例/929人年)、プラセボ投与群が0.46/100人年(2例/433人年)でした。また、対照及び非対照期間において、6709名(11561人年)に本剤が投与されました。その追跡調査中央値は1.0年で、尋常性乾癬を対象とした臨床試験では3.3年、関節症性乾癬を対象とした臨床試験では1.0年、クローン病(承認外効能・効果)を対象とした臨床試験では0.6年、潰瘍性大腸炎(承認外効能・効果)を対象とした臨床試験では1.0年でした。非黒色腫皮膚癌を除く悪性腫瘍の発現頻度は、0.54/100人年(62例/11561人年)で、主なものは前立腺癌、結腸直腸癌、黒色腫、乳癌でした。本剤投与群で報告された悪性腫瘍の発現頻度は、一般人口で予測される発現頻度と同様でした(標準化発生比:0.93[95%信頼区間:0.71、1.20]年齢、性別、人種により補正)。非黒色腫皮膚癌の発現頻度は0.49/100人年(56例/11545人年)でした。皮膚基底細胞癌と皮膚有棘細胞の発現 比率は3:1であり一般人口で予測される発現頻度と同様でした。
対処方法
- 悪性腫瘍の発現が認められた場合は、本剤の投与を中止し、悪性腫瘍に対する治療を行ってください。必要に応じて専門医へ紹介してください。
投与中の注意事項
- 投与中は定期的ながん検診を受けるように患者様にご指導ください。
副作用一覧
〈日本人健康成人を含む海外第Ⅰ相試験(AVT04-GL-101試験:海外データ)〉
| [目的] | 健康成人を対象として、本剤と先行バイオ医薬品(欧州で承認されたウステキヌマブ製剤[EU−先行バイオ医薬品]及び米国で承認されたウステキヌマブ製剤[US-先行バイオ医薬品])の薬物動態、安全性、忍容性、及び免疫原性プロファイルを比較し、本剤と先行バイオ医薬品の同等性を実証する。 |
|---|---|
| [試験デザイン] | 二重盲検、無作為化、単回投与、多施設共同並行3群間比較試験 |
| [対象] | 日本人を含む健康な男性及び女性 294例 |
| [試験方法] | 1日目に本剤、EU−先行バイオ医薬品又はUS−先行バイオ医薬品(45mg/0.5mL)を腹部又は大腿部に単回皮下投与した。 |
安全性解析対象集団は以下の通りであった。
本剤:98例(日本人7例を含む)
EU−先行バイオ医薬品:97例(日本人6例を含む)
US−先行バイオ医薬品:99例(日本人7例を含む)
本剤群で有害事象が98例中67例(68.4%)151件、副作用が34例(34.7%)46件報告され、EU−先行バイオ医薬品群は99例中67例(67.7%)155件、副作用が34例(34.3%)59件、US−先行バイオ医薬品群は97例中69例(71.1%)190件、副作用が43例(44. 3%)61件報告された。死亡、投与中止に至った有害事象は報告されなかった。
第Ⅰ相臨床試験における副作用発現状況
| 副作用 | 本剤群 (n=98) |
EU群 (n=99) |
US群 (n=97) |
|||
|---|---|---|---|---|---|---|
| 発現例数(%) | 件数 | 発現例数(%) | 件数 | 発現例数(%) | 件数 | |
| 全ての副作用 | 34(34.7) | 46 | 34(34.3) | 59 | 43(44.3) | 61 |
| 神経系障害 | 14(14.3) | 15 | 10(10.1) | 11 | 11(11.3) | 11 |
| 頭痛 | 12(12.2) | 12 | 7(7.1) | 8 | 9(9.3) | 9 |
| 浮動性めまい | 1(1.0) | 1 | 3(3.0) | 3 | 1(1.0) | 1 |
| 嗜眠 | 1(1.0) | 1 | 1(1.0) | 1 | ||
| 片頭痛 | 1(1.0) | 1 | ||||
| 錯覚 | 1(1.0) | 1 | ||||
| 一般・全身障害及び投与部位の状態 | 10(10.2) | 10 | 10(10.1) | 11 | 14(14.4) | 15 |
| 注射部位紅斑 | 4(4.1) | 4 | 4(4.0) | 4 | 5(5.2) | 5 |
| 疲労 | 1(1.0) | 1 | 2(2.0) | 2 | 3(3.1) | 3 |
| 注射部位疼痛 | 2(2.0) | 2 | 1(1.0) | 1 | 2(2.1) | 3 |
| 注射部位内出血 | 2(2.0) | 2 | 1(1.0) | 1 | 1(1.0) | 1 |
| 注射部位そう痒感 | 1(1.0) | 1 | 1(1.0) | 1 | ||
| 胸部不快感 | 1(1.0) | 1 | ||||
| 注射部位反応 | 1(1.0) | 1 | ||||
| 注射部位腫脹 | 1(1.0) | 1 | ||||
| 注射部位蕁麻疹 | 1(1.0) | 1 | ||||
| 穿刺部位紅斑 | 1(1.0) | 1 | ||||
| 感染症及び寄生虫症 | 9(9.2) | 9 | 8(8.1) | 8 | 9(9.3) | 9 |
| 上気道感染 | 3(3.1) | 3 | 4(4.0) | 4 | 4(4.1) | 4 |
| 尿路感染 | 1(1.0) | 1 | 2(2.0) | 2 | 2(2.1) | 2 |
| COVID-19 | 1(1.0) | 1 | ||||
| 毛包炎 | 1(1.0) | 1 | ||||
| ウイルス性胃腸 | 1(1.0) | 1 | ||||
| インフルエンザ | 1(1.0) | 1 | ||||
| ウイルス性下気道感染 | 1(1.0) | 1 | ||||
| 伝染性軟属腫 | 1(1.0) | 1 | ||||
| 中耳炎 | 1(1.0) | 1 | ||||
| 肺炎 | 1(1.0) | 1 | ||||
| 皮膚感染 | 1(1.0) | 1 | ||||
| 外陰部腟カンジダ | 1(1.0) | 1 | ||||
| 胃腸障害 | 3(3.1) | 3 | 7(7.1) | 10 | 9(9.3) | 10 |
| 悪心 | 6(6.1) | 6 | 3(3.1) | 3 | ||
| 嘔吐 | 3(3.0) | 3 | 2(2.1) | 2 | ||
| 腹痛 | 2(2.0) | 2 | ||||
| 下痢 | 2(2.1) | 2 | ||||
| 腹部膨満 | 1(1.0) | 1 | ||||
| 下腹部痛 | 1(1.0) | 1 | ||||
| 便秘 | 1(1.0) | 1 | ||||
| 鼓張 | 1(1.0) | 1 | ||||
| 歯痛 | 1(1.0) | 1 | ||||
| 筋骨格系及び結合組織障害 | 3(3.1) | 3 | 6(6.1) | 6 | 1(1.0) | 1 |
| 筋肉痛 | 2(2.0) | 2 | 2(2.0) | 2 | ||
| 背部痛 | 2(2.0) | 2 | ||||
| 筋痙攣 | ||||||
| 筋力低下 | 1(1.0) | 1 | ||||
| 筋骨格系胸痛 | ||||||
| 四肢痛 | ||||||
| 皮膚及び皮下組織障害 | 1(1.0) | 1 | 3(3.0) | 4 | 6(6.2) | 7 |
| 発疹 | 1(1.0) | 1 | 3(3.1) | 3 | ||
| ざ瘡 | 1(1.0) | 1 | 1(1.0) | 1 | ||
| 皮膚乾燥 | 1(1.0) | 1 | ||||
| 湿疹 | 1(1.0) | 1 | ||||
| 紅斑 | 1(1.0) | 1 | ||||
| 汗疹 | 1(1.0) | 1 | ||||
| 斑状丘疹状皮疹 | 1(1.0) | 1 | ||||
| 蕁麻疹 | 1(1.0) | 1 | ||||
| 呼吸器、胸部及び縦隔障害 | 3(3.0) | 3 | 2(2.1) | 2 | ||
| 発生障害 | 1(1.0) | 1 | ||||
| 鼻出血 | 1(1.0) | 1 | ||||
| 口腔咽頭痛 | 1(1.0) | 1 | ||||
| 鼻漏 | 1(1.0) | 1 | ||||
| 副鼻腔うっ血 | 1(1.0) | 1 | ||||
| 心臓障害 | 1(1.0) | 1 | 2(2.1) | 2 | ||
| 動悸 | 2(2.1) | 2 | ||||
| 結節性調律 | 1(1.0) | 1 | ||||
| 生殖系及び乳房障害 | 1(1.0) | 1 | 2(2.0) | 2 | ||
| 乳房痛 | 1(1.0) | 1 | ||||
| 月経遅延 | 1(1.0) | 1 | ||||
| 外陰腟不快感 | 1(1.0) | 1 | ||||
| 耳及び迷路障害 | 1(1.0) | 1 | ||||
| 耳痛 | 1(1.0) | 1 | ||||
| 耳管機能障害 | 1(1.0) | 1 | ||||
| 臨床検査 | 1(1.0) | 1 | 1(1.0) | 1 | ||
| 結核菌群検査陽性 | 1(1.0) | 1 | ||||
| ビタミンD減少 | 1(1.0) | 1 | ||||
| 血管障害 | 1(1.0) | 1 | 1(1.0) | 1 | ||
| 潮紅 | 1(1.0) | 1 | ||||
| 高血圧 | 1(1.0) | 1 | ||||
| 血液及びリンパ系障害 | 1(1.0) | 1 | ||||
| 好中球減少症 | 1(1.0) | 1 | ||||
| 免疫系障害 | 1(1.0) | 1 | ||||
| 過敏症 | 1(1.0) | 1 | ||||
| 傷害、中毒及び処置合併症 | 1(1.0) | 1 | ||||
| 口蓋損傷 | 1(1.0) | 1 | ||||
| 代謝及び栄養障害 | 1(1.0) | 1 | ||||
| 脱水 | 1(1.0) | 1 | ||||
| 腎及び尿路障害 | 1(1.0) | 1 | ||||
| 膀胱刺激症状 | 1(1.0) | 1 | ||||
MedDRA Version 24.0
〈海外第III相臨床試験(AVT04-GL-301試験:海外データ)〉
| [目的] | 中等症から重症の慢性尋常性乾癬患者を対象として、本剤と先行バイオ医薬品(欧州で承認されたウステキヌマブ製剤[EU−先行バイオ医薬品])の治療学的同等性を実証する。 |
|---|---|
| [試験デザイン] | 二重盲検、無作為化、多施設共同臨床試験 |
| [対象] | 中等症から重症の慢性尋常性乾癬患者 581例 |
| [試験方法] |
本試験は以下の2つのstageで構成され、Stage 1では15週目まで二重盲検下で主要有効性の評価を、以後のStage 2では52週目まで二重盲検下で長期有効性及び安全性の評価を行った。 Stage 1(15週目まで) 1日目において組み入れた患者を本剤群とEU-先行バイオ医薬品群に1:2の比率で無作為に割り付けた。 本剤群:本剤45mg(体重100kg以下)又は90mg(体重100kg超)の初回皮下投与を実施し、その4週間後に45mg又は90mg投与した。 EU−先行バイオ医薬品群:EU−先行バイオ医薬品45mg(体重100kg以下)又は90mg(体重100kg超)の初回皮下投与を実施し、その4週間後に45mg又は90mg投与した。 Stage 2(16週目~ 52週目まで) 16週目からStage 2を開始した。 最初に本剤群に無作為化された患者[本剤/本剤群]は16、28、40週目の12週間ごとに本剤45mg(体重100kg以下) 又は90mg(体重100kg超)の皮下投与を継続した。 最初にEU−先行バイオ医薬品群に無作為化された患者は本剤群[EU/本剤群]とEU−先行バイオ医薬品群[EU/EU群]に1:1の比率で再度無作為化された。 EU/本剤群:患者は16、28、及び40週目の12週ごとに本剤45mg(体重100kg以下)又は90mg(体重100kg超)の皮下投与を継続した。 EU/EU群:患者は16、28、及び40週目の12週ごとにEU−先行バイオ医薬品45mg(体重100kg以下)又は90mg(体重100kg超)の皮下投与を継続した。 |
Stage 1(15週目まで)
本剤群で有害事象が194例中67例(34.5%)104件、副作用が10例(5.2%)13件報告され、EU−先行バイオ医薬品群はそれぞれ387例中130例(33.6%)223件、37例(9.6%)39件で同様であった。
Stage 2(16週目~28週目まで)
本剤/本剤群で有害事象が193例中21例(10.9%)26件、EU/本剤群で192例中30例(15.6%)35件、EU/EU群で、189例中29例(15.3%)36件報告された。副作用は本剤/本剤群では認められず、EU/本剤群では5例(2.6%)5件、EU/EU群では2例(1.1%)2件報告された。
Stage 2(28週目~ 52週目まで)
本剤/本剤群で有害事象が191例中32例(16.8%)49件、EU/本剤群で184例中42例(22.8%)66件、EU/EU群で、184例中39例(21.2%)49件報告された。副作用は本剤/本剤群では認められず、EU/本剤群では3例(1.6%)4件、EU/EU群では6例(3.3%)8件報告された。本試験期間中に死亡、投与中止に至った有害事象は報告されなかった。全患者群又は体重100kg以下の患者の投与群間で顕著な不均衡は認められなかった。
第III相臨床試験における副作用発現状況(15週目まで)
| 副作用 | 本剤群 (n=194) |
EU群 (n=387) |
||
|---|---|---|---|---|
| 発現例数(%) | 件数 | 発現例数(%) | 件数 | |
| 全ての副作用 | 10(5.2) | 13 | 37(9.6) | 39 |
| 感染症及び寄生虫症 | 6(3.1) | 6 | 14(3.6) | 14 |
| 上気道感染 | 3(1.5) | 3 | 7(1.8) | 7 |
| 上咽頭炎 | 2(1.0) | 2 | 3(0.8) | 3 |
| 単純ヘルペス | 0 | 0 | 1(0.3) | 1 |
| 口腔ヘルペス | 0 | 0 | 1(0.3) | 1 |
| 咽頭炎 | 1(0.5) | 1 | 0 | 0 |
| 鼻炎 | 0 | 0 | 1(0.3) | 1 |
| 副鼻腔炎 | 0 | 0 | 1(0.3) | 1 |
| 一般・全身障害及び投与部位の状態 | 2(1.0) | 3 | 12(3.1) | 13 |
| 注射部位反応 | 2(1.0) | 3 | 9(2.3) | 9 |
| 注射部位疼痛 | 0 | 0 | 1(0.3) | 2 |
| 無力症 | 0 | 0 | 1(0.3) | 1 |
| 注射部位血腫 | 0 | 0 | 1(0.3) | 1 |
| 皮膚及び皮下組織障害 | 0 | 0 | 6(1.6) | 6 |
| そう痒症 | 0 | 0 | 3(0.8) | 3 |
| ざ瘡 | 0 | 0 | 1(0.3) | 1 |
| アレルギー性皮膚炎 | 0 | 0 | 1(0.3) | 1 |
| 乾癬 | 0 | 0 | 1(0.3) | 1 |
| 神経系障害 | 0 | 0 | 3(0.8) | 3 |
| 頭痛 | 0 | 0 | 2(0.5) | 2 |
| 傾眠 | 0 | 0 | 1(0.3) | 1 |
| 胃腸障害 | 1(0.5) | 1 | 1(0.3) | 1 |
| 下痢 | 0 | 0 | 1(0.3) | 1 |
| 歯の浸食 | 1(0.5) | 1 | 0 | 0 |
| 血管障害 | 0 | 0 | 2(0.5) | 2 |
| 血腫 | 0 | 0 | 2(0.5) | 2 |
| 心臓障害 | 1(0.5) | 1 | 0 | 0 |
| 不整脈 | 1(0.5) | 1 | 0 | 0 |
| 代謝及び栄養障害 | 1(0.5) | 1 | 0 | 0 |
| 食欲減退 | 1(0.5) | 1 | 0 | 0 |
| 呼吸器、胸郭及び縦隔障害 | 1(0.5) | 1 | 0 | 0 |
| 口腔咽頭痛 | 1(0.5) | 1 | 0 | 0 |
MedDRA/J Ver. 25.1
第III相臨床試験における副作用発現状況(16~28週目)
| 副作用 | 本剤/本剤群 (n=193) |
EU/本剤群 (n=192) |
EU/EU群 (n=189) |
|||
|---|---|---|---|---|---|---|
| 発現例数(%) | 件数 | 発現例数(%) | 件数 | 発現例数(%) | 件数 | |
| 全ての副作用 | 0 | 0 | 5(2.6) | 5 | 2(2.1) | 2 |
| 一般・全身障害及び投与部位の状態 | 0 | 0 | 2(1.0) | 2 | 1(0.5) | 1 |
| 注射部位反応 | 0 | 0 | 1(0.5) | 1 | 1(0.5) | 1 |
| 注射部位血腫 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 感染症及び寄生虫症 | 0 | 0 | 2(1.0) | 2 | 0 | 0 |
| COVID-19 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 上気道感染 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 肝胆道系障害 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 高トランスアミナーゼ血症 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 臨床検査 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| アラニンアミノトランスフェラーゼ増加 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
MedDRA/J Ver. 25.1
第III相臨床試験における副作用発現状況(28~52週目)
| 副作用 | 本剤/本剤群 (n=191) |
EU/本剤群 (n=184) |
EU/EU群 (n=184) |
|||
|---|---|---|---|---|---|---|
| 発現例数(%) | 件数 | 発現例数(%) | 件数 | 発現例数(%) | 件数 | |
| 全ての副作用 | 0 | 0 | 3(1.6) | 4 | 6(3.3) | 8 |
| 一般・全身障害及び投与部位の状態 | 0 | 0 | 2(1.1) | 3 | 2(1.1) | 2 |
| 注射部位反応 | 0 | 0 | 1(0.5) | 2 | 2(1.1) | 2 |
| 注射部位疼痛 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 感染症及び寄生虫症 | 0 | 0 | 1(0.5) | 1 | 2(1.1) | 2 |
| COVID-19 | 0 | 0 | 1(0.5) | 1 | 0 | 0 |
| 上咽頭炎 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| 上気道感染 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| 臨床検査 | 0 | 0 | 0 | 0 | 1(0.5) | 3 |
| アラニンアミノトランスフェラーゼ増加 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| アスパラギン酸アミノトランスフェラーゼ増加 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| γ-グルタミルトランスフェラーゼ増加 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| 筋骨格系及び結合組織障害 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
| 筋肉痛 | 0 | 0 | 0 | 0 | 1(0.5) | 1 |
MedDRA/J Ver. 25.1

